Quando se discute a integralidade do cuidado dos pacientes com doenças raras, é inescapável abordar o acesso a medicamentos e a equipamentos de saúde, que trazem a perspectiva de retardar o avanço de doenças que são graves, debilitantes e progressivas, se utilizadas no momento adequado e no paciente correto.
No entanto, a Portaria 199/2014 não define mecanismos específicos para a garantia de acesso a tecnologias, deixando a decisão vinculada aos processos já existentes de incorporação, notadamente junto à CONITEC.
Para ver as imagens, coloque o smartphone na posição horizontal.
No Brasil, seguindo o movimento global, a Agência Nacional de Vigilância Sanitária (ANVISA) aprovou, em dezembro de 2017, a Resolução da Diretoria Colegiada (RDC) nº 205 , criando um procedimento especial para dar celeridade ao registro de medicamentos para doenças raras. Considerando apenas 2019, 1924 medicamentos para doenças raras foram registrados no país, 10 deles utilizando a RDC nº 205 .
Nos últimos anos, a criação de políticas de incentivo ao desenvolvimento de drogas órfãs em diversos países resultou no surgimento de muitos medicamentos inovadores. Isso possibilitou mudar a história natural de diversas doenças raras e ultrarraras, trazendo maior qualidade e expectativa de vida aos pacientes, ainda que apenas 5% das doenças raras tenham tratamento aprovado atualmente pela agência norte-americana (Food and Drug Administration, FDA). Dada a gravidade das doenças, esses medicamentos, enquanto única alternativa medicamentosa, acabam chegando aos países com menor tempo de estudos clínicos, populações reduzidas e, portanto, com maiores incertezas sobre os resultados alcançados, o que acaba por suscitar possíveis críticas em relação a eles e à indústria farmacêutica, principalmente daqueles que conhecem pouco ou simplesmente desconhecem as realidades das pessoas com doenças raras e seus familiares.
A chegada desses medicamentos ao país acaba por gerar um ambiente de pressão sobre os gestores públicos, sobretudo sobre o Ministério da Saúde, para que viabilize o acesso a eles através do SUS. Uma comunidade de paciente mais informada e organizada, a exposição internacional de médicos especialistas, o trabalho informativo da indústria farmacêutica e a abertura dada pela classe política ao assunto, em todos os níveis de governo, foram determinantes nos últimos três anos para viabilizar o acesso a esses medicamentos no Brasil.
Figura 1: Decisões da Conitec sobre tecnologias para doenças raras por ano
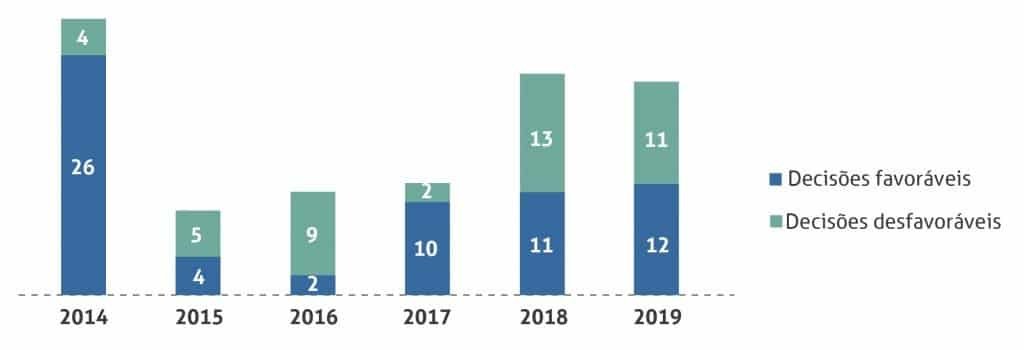
Vale destacar que os medicamentos para doenças raras tendem a ser de alto custo, sendo ofertados por meio do chamado Componente Especializado da Assistência Farmacêutica (CEAF – Grupo 1-A), o que implica na sua aquisição de forma centralizada pelo governo federal. Por esta razão, as demandas de incorporação desses medicamentos no SUS são direcionadas à CONITEC. Desde a publicação da Portaria 199/2014, 109 tecnologias para doenças raras foram analisadas pela Comissão, entre medicamentos, produtos para a saúde e procedimentos; 59% delas (65) tiveram recomendação positiva para a incorporação ou ampliação de uso. É importante, contudo, analisar o contexto dessas decisões ao longo dos anos.
Em 2014, tal como se verifica no gráfico acima, houve um pico de decisões de incorporação (26), logo após a publicação da Portaria 199. Dessas 26 tecnologias incorporadas, contudo, 18 já faziam parte da lista de procedimentos diagnósticos previstos pela Portaria 199/2004 e que seriam realizados pelos serviços habilitados, com seus valores de reembolso fixados na Tabela de Procedimentos, Medicamentos e OPME do SUS. Assim, excluindo estes procedimentos, foram 8 as tecnologias incorporadas naquele momento em que o debate sobre o tema estava latente.
Nos dois anos seguintes (2015-2016), houve um número baixo de incorporações (6), mas que acompanhou o número igualmente baixo de solicitações de incorporação submetidas à CONITEC (foram 20). Nesse período, mesmo que o número de tecnologias para doenças raras incorporados ao SUS não tenha sido elevado, o Ministério da Saúde estava diante de um aumento significativo de gastos com o fornecimento de medicamentos para doenças raras pela via judicial, conforme indica o gráfico abaixo.
Figura 2: Gastos do Ministério da Saúde com demandas judiciais (R$ milhões)
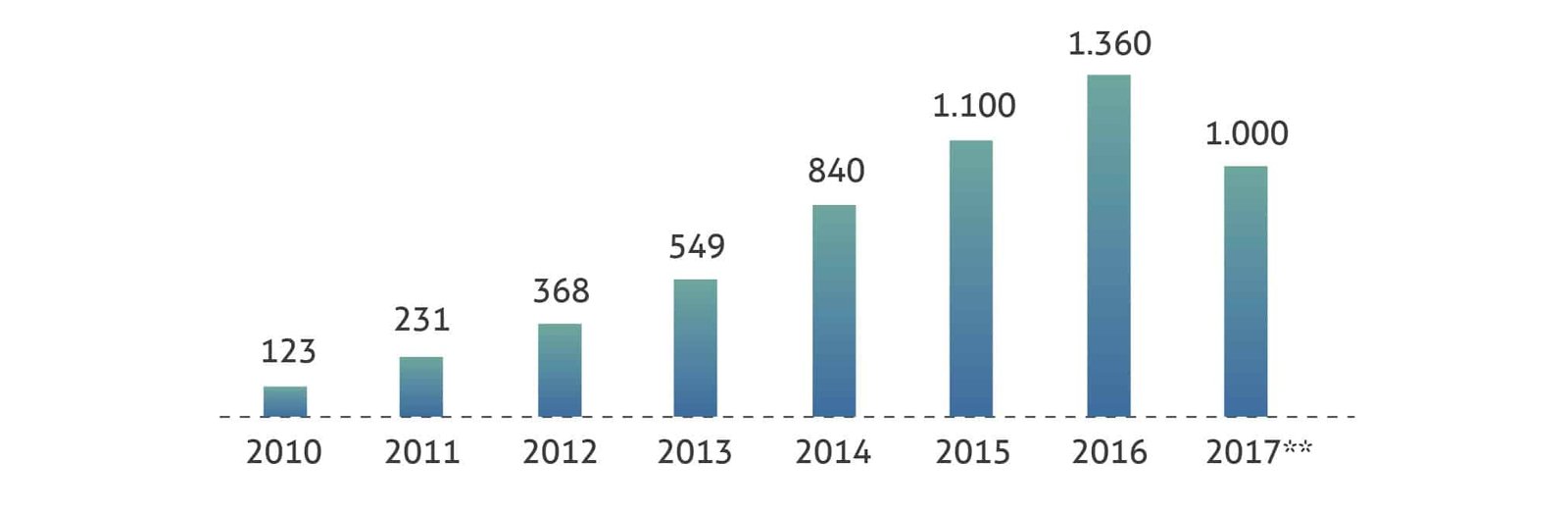
Para a gestão pública, o uso do orçamento para atender determinações judiciais traz um elevado grau de ineficiência em diversas frentes:
- financeira, na medida em que as compras são feitas, em princípio, para atender demandas individuais, muitas vezes sem licitação ou com pouca ou nenhuma margem para negociação de preços;
- organizacional, sob a perspectiva da rede de cuidado, visto que não há garantia de que o paciente beneficiado será devidamente acompanhado pelo sistema de saúde e por profissionais da rede; e
- clínica, uma vez que o produto fornecido pode não ser armazenado corretamente pelo paciente, gerando perdas de eficácia e afetando o seu tratamento.
Portanto, o aumento do número de incorporações a partir de 2017 pode ser atribuído à necessidade de se garantir o maior controle de gastos pelo Ministério da Saúde, mas também combinado a fatores como pressão social e política, conforme já destacado.
Aqui, vale dar um passo atrás para entender as tendências de incorporação que serão apresentadas mais adiante. A chegada de medicamentos inovadores no país e a crescente demanda da população por acesso não foi acompanhada de uma maior disponibilidade de orçamento para realizar novas incorporações. Pelo contrário, o orçamento da assistência farmacêutica, em especial o do CEAF, sofreu queda nos últimos anos, o que torna ainda mais desafiadora a ampliação do acesso a novas terapias. Esta situação dificilmente dá sinais de mudança no curto prazo, sobretudo em um cenário pós-pandemia, em que os gastos extraordinários do governo federal aumentaram exponencialmente, houve queda de arrecadação e a situação fiscal dos estados segue delicada.
Este descompasso obriga os gestores a encontrar formas alternativas de viabilizar o acesso a novas tecnologias pela população, além das já praticadas negociações de preços (pressão sobre a indústria). Em dezembro de 2018, a CONITEC publicou a recomendação de incorporação de três medicamentos para doenças raras mediante a observância das seguintes condições:
- Protocolo de uso estabelecido pelo Ministério da Saúde;
- Atendimento e tratamento restritos a hospitais da Rede Nacional de Pesquisa Clínica;
- Registro dos dados clínicos e farmacêuticos em sistema nacional informático do SUS;
- Uso ad experimentum (reavaliação em 3 anos);
- Laudo próprio para dispensação do medicamento;
- Fornecimento aos respectivos hospitais; e
- Negociação para redução significante de preço.
Figura 3: Orçamento da Assistência Farmacêutica (Federal , em R$ bilhões
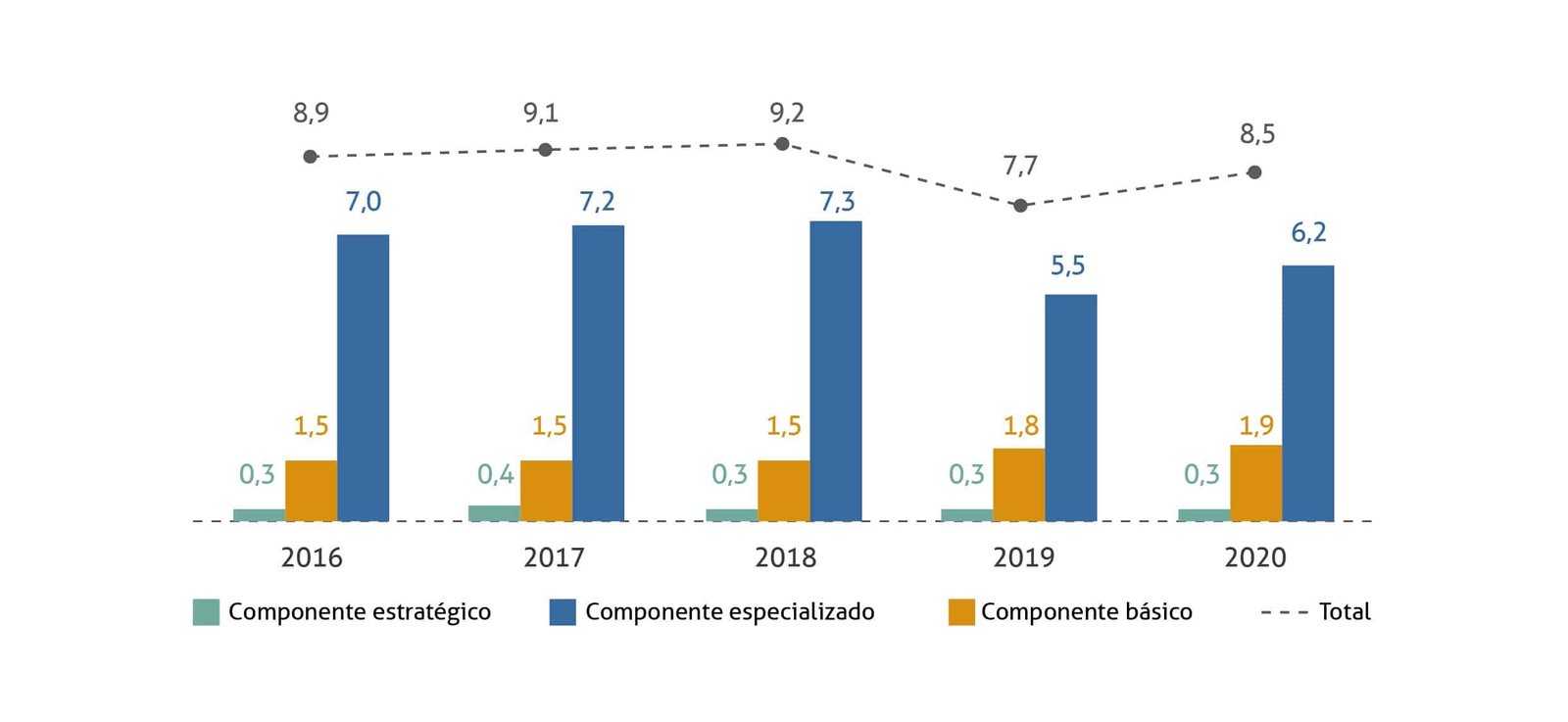
Com isso, o Ministério buscou ampliar o controle sobre o uso dos medicamentos no SUS, com a dispensação em hospitais específicos; gerar dados que apoiem uma reavaliação futura do medicamento, com o registro de dados clínicos; e colocar a empresa fornecedora como parte responsável no processo de acesso, com o apoio logístico para o fornecimento do medicamento em local específico, fundamental para evitar riscos de desvios. Condicionantes inéditas como estas foram trazidas em incorporações posteriores e devem se manter nos próximos anos.
É nesse contexto que o Ministério da Saúde estabeleceu, em 2019, o projeto-piloto do primeiro Acordo de Compartilhamento de Risco (ACR) no país. O Acordo envolve uma divisão de responsabilidades relacionada ao fornecimento do medicamento, entre o Ministério e a indústria produtora. (Nota da Redação: este projeto-piloto foi descontinuado) Esse tipo de acordo se encaixa muito bem no cenário das doenças raras, onde existem poucos dados sobre a população de pacientes, onde há poucas pesquisas sobre a relação custo-efetividade dos medicamentos e onde as tecnologias costumam ter valores mais elevados.
O projeto tem o objetivo de atrelar contrapartidas financeiras a desfechos clínicos esperados, o que traz complexidade para sua implementação. Para que isso se verifique, é essencial o trabalho de coleta de dados de mundo real, que depende de uma rede de cuidado organizada que garanta o tratamento, o cuidado e o acompanhamento correto do paciente, elementos que influenciam o alcance de um resultado clínico satisfatório. Os resultados deste projeto podem dar insumos para que o Ministério da Saúde, bem como os gestores de outros níveis de governo, avance com modelos alternativos de remuneração e acesso a novas tecnologias.
Por ora, a complexidade do SUS e da burocracia da máquina pública, com seus diversos níveis de coordenação, modelos de contratação de prestadores de serviços e fontes de financiamento, sinalizam que os modelos de compartilhamento de risco de natureza exclusivamente financeira, com a fixação de teto de pacientes atendidos ou de volume máximo de medicamentos a serem adquiridos, sejam mais viáveis do que o que pressupõe mensuração de resultados clínicos do medicamento. Em ambos os casos, no entanto, ainda é preciso avançar no arcabouço normativo para dar segurança jurídica a todas as partes – governo e setor privado – e permitir modelos alternativos de compras.
Essas alternativas (condicionantes e compartilhamento de risco) que vêm sendo utilizadas pelo Ministério são importantes para a discussão sobre a garantia do acesso a novas terapias e devem permanecer na agenda dos gestores do SUS, sobretudo com a perspectiva de chegada das chamadas terapias gênicas ao Brasil. Elas reforçam, além da importância da cooperação entre o setor público e o setor privado, a necessidade de haver uma rede de cuidado ao paciente com doenças raras mais estruturada e integrada. Isso passa não só pelos serviços habilitados, mas pela necessária comunicação com toda a rede de serviços de atenção básica e com o cuidado multidisciplinar, como já mencionado.
Leia os outros posts desta série!

Para ter acesso aos posts desta série publicados até o momento, clique aqui.




