Como está a Itália está se saindo em termos de acesso a medicamentos órfãos?
Muito bem, de acordo com um novo relatório do Observatório Farmaci Orfani (OSSFOR; Observatório de Medicamentos Órfãos), embora haja espaço para melhorias.
Dos 130 medicamentos órfãos licenciados pela EMA até o final de dezembro de 2021, 122 (94%) estavam disponíveis na Itália em 31 de agosto de 2022, da seguinte forma:
- 22 na classe A (disponíveis em ambulatório e totalmente reembolsados)
- 75 na classe H (restrito ao ambiente de internação e totalmente reembolsado)
- 16 na classe C (disponíveis em ambulatório, mas não reembolsados)
- 8 na classe Cnn (disponível no ambiente ambulatorial, mas não reembolsado pendente de negociação)
As despesas com medicamentos órfãos aumentaram de 609 milhões de euros em 2013 para 1,54 mil milhões de euros em 2021, mas mantiveram-se em 6,4 % da despesa farmacêutica total
O tempo médio entre a autorização de introdução no mercado e a primeira decisão de fixação de preços e reembolso pela AIFA é de 19 meses, sem diferença entre medicamentos oncológicos e não-oncológicos.
No entanto, o tempo médio necessário para chegar a uma decisão é muito mais curto para os medicamentos classificados como inovadores (14 meses) pela Agenzia Italiana del Farmaco (AIFA) do que para os medicamentos não-inovadores (21 meses).
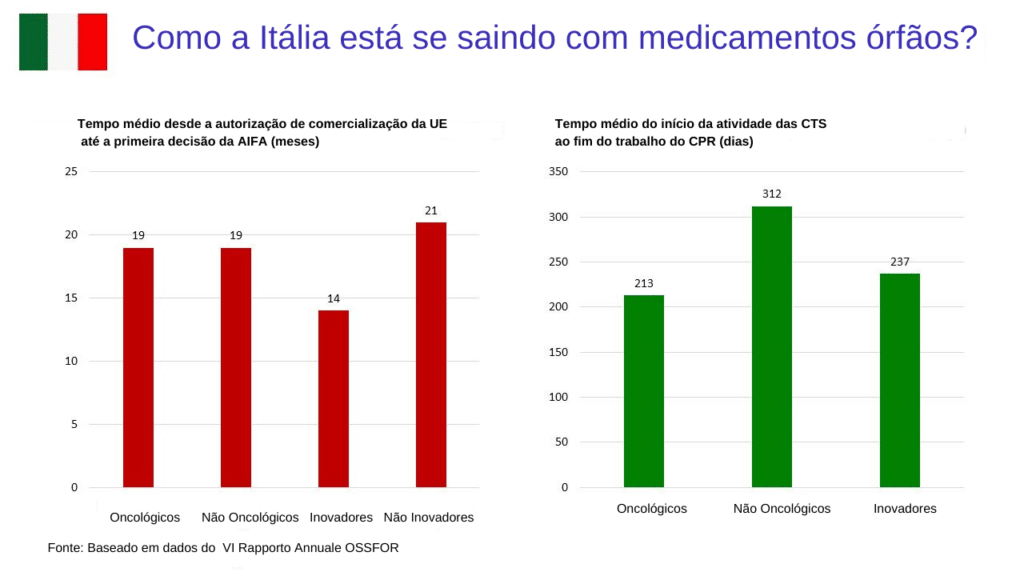
O tempo necessário para que a Comissão Técnico-Científica (CTS) e o Comitê de Preços e Reembolso (CPR) da AIFA concluam seu trabalho aumentou de uma média de 149 dias em 2010-2012 para 245 dias em 2019-2021.
Uma análise de uma amostra de 88 medicamentos órfãos nas classes ATC A, J e L constatou que o tempo médio desde o início da atividade da STC até a conclusão do trabalho da RCP foi de 214 dias para medicamentos oncológicos, mas 312 dias para medicamentos não-oncológicos.
Para medicamentos inovadores, o tempo médio decorrido foi de 237 dias. No entanto, o processo deve levar no máximo 100 dias – um prazo cumprido por apenas 15% dos medicamentos analisados no estudo.
Será interessante verificar se a iminente substituição da STC e da RCP por uma nova Comissão Científica e Económica Combinada para Produtos Farmacêuticos (CSE) acelera o processo .
A OSSFOR relata que 38% dos medicamentos órfãos estão agora incluídos nos registros de monitoramento de AIFA. Além disso, 26% dos tratamentos para doenças raras estão sujeitos a acordos de compartilhamento de risco – baseados em desempenho ou volume.
A Itália dispõe de várias vias de acesso antecipado a novos medicamentos promissores, incluindo a Lei 648/96, que permite a prescrição de medicamentos não autorizados, ou a prescrição off-label de medicamentos autorizados, em circunstâncias específicas.
No entanto, a utilização desta disposição tem sido limitada nos últimos anos: houve apenas quatro candidaturas (três recusadas) em 2020 e seis candidaturas (cinco recusadas e uma pendente) em 2021.
O subsecretário de Saúde, Marcello Gemmato, acaba de assumir a responsabilidade pela política de doenças raras na Itália. Ele comentou: “Os objetivos são claros: melhorar o acesso às terapias, superar as desigualdades regionais, explorar efetivamente as redes e o uso de dados, implementar plenamente a Lei 175/2021 [Lei Consolidada sobre Doenças Raras com maior rapidez”.
Neil Grubert é especialista em acesso ao mercado farmacêutico com mais de 30 anos de experiência no rastreamento dos mercados globais de medicamentos. Ele é autor de mais de 150 relatórios sobre acesso ao mercado, cobrindo 20 mercados maduros e emergentes, várias áreas terapêuticas e vários problemas do setor. Atualmente trabalha como consultor independente. O blog Academia de Pacientes detém direitos exclusivos de reprodução dos posts de Neil Grubert em lingua portuguesa.

