Grandes variações na disponibilidade de novos medicamentos na Europa1 persistem, de acordo com dados recentes publicados pela European Federation of Pharmaceutical Industries and Associations (EFPIA). A pesquisa EFPIA Patients WAIT Indicator 2022 foi lançada apenas dois dias depois que a Comissão Europeia destacou a necessidade de combater as disparidades no acesso a medicamentos em sua proposta de reforma da legislação farmacêutica geral da UE .
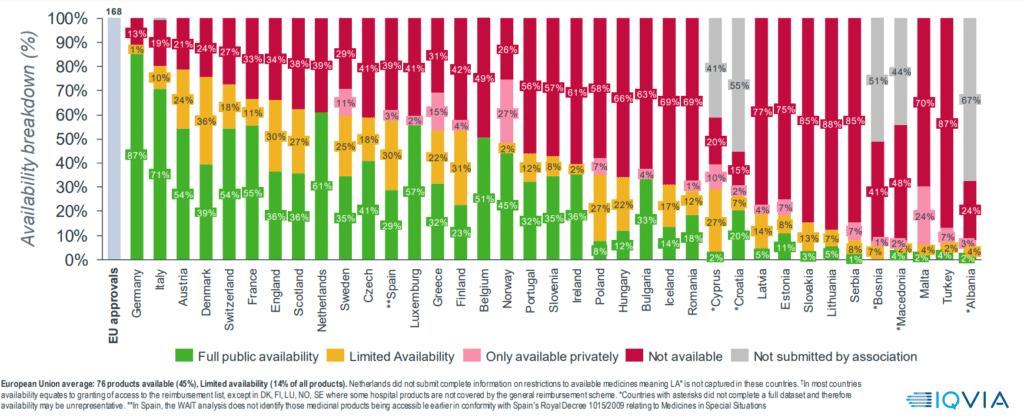
O estudo cobre a disponibilidade (ou seja, inclusão em listas públicas de reembolso2 ) em todos os estados-membros da União Européia (UE) e mais 10 outros países de 168 produtos que receberam autorização de comercialização da UE de 2018 a 20213. A taxa média de disponibilidade na UE foi de 45% em 2022 – abaixo de 47% em 2021. No entanto, é importante observar que essas porcentagens incluem disponibilidade “limitada” – por exemplo, restrição de cobertura a certas subpopulações, uso por pacientes identificados, reembolso temporário (pendente de decisão permanente) ou acordo de compartilhamento de risco.
A disponibilidade variou amplamente, mesmo entre os cinco grandes mercados europeus. A Alemanha teve de longe a taxa mais alta: 88% (incluindo 87% de disponibilidade total). A Itália ficou em segundo lugar, com 71% de disponibilidade total e 10% de disponibilidade limitada. A França teve 55% de disponibilidade total e 11% de disponibilidade limitada. A Inglaterra teve 36% de disponibilidade total e 30% de disponibilidade limitada, provavelmente refletindo a tendência do NICE de “otimizar” a cobertura para certas subpopulações e o uso de acordos de compartilhamento de risco. A Espanha apresentou 29% de disponibilidade total e 30% de disponibilidade limitada, embora estes números não incluíssem o acesso a medicamentos em situações especiais do Real Decreto 1015/2009.
Em comparação, vários estados-membros menores da UE – Letônia, Estônia, Eslováquia, Lituânia e Malta – tiveram taxas totais de disponibilidade abaixo de 20%.
O tempo médio de disponibilidade na UE aumentou marginalmente de 511 dias em 2021 para 517 dias em 2022. A Alemanha foi a mais rápida (média de 128 dias), enquanto Malta foi a mais lenta (média de 1.351 dias).
Ampla variação da disponibilidade de novos medicamentos na Europa
Na publicação das propostas da Comissão para a reforma da legislação farmacêutica, a Comissária da Saúde, Stella Kyriakides, disse: “Não podemos ter cidadãos de primeira e segunda classes quando se trata de acesso a medicamentos na UE. Esta reforma é sobre não deixar ninguém para trás.” E acrescentou: “A inovação tem que chegar aos pacientes para ter valor para a sociedade”.
A EFPIA certamente concorda com a última afirmação, mas vê a necessidade de se estar ciente de todos os fatores que contribuem para o acesso baixo e lento. Para esse fim, a entidade divulgou os primeiros dados de seu novo Portal de Acesso Europeu, bem como uma Análise de Causas Fundamentais para atrasos.
A inovação tem que chegar aos pacientes para ter valor para a sociedade
Stella Kyriakides, Comissária de Saúde da União Européia
De acordo com EFPIA, “os dados mostram que nenhum setor, organização ou legislação pode abordar questões de acesso a medicamentos isoladamente. Para haver um progresso real na provisão de igualdade de acesso a tratamentos em toda a Europa, é necessária uma coalizão de parceiros dispostos a co-criar soluções baseadas em evidências: a EFPIA está pedindo a seus parceiros europeus que intensifiquem tais esforços”.
Leia também:
Como anda o acesso a medicamentos inovadores na Europa?
Estudo avalia disponibilidade de medicamentos inovadores na América Latina
Neil Grubert é especialista em acesso ao mercado farmacêutico com mais de 30 anos de experiência no rastreamento dos mercados globais de medicamentos. Ele é autor de mais de 150 relatórios sobre acesso ao mercado, cobrindo 20 mercados maduros e emergentes, várias áreas terapêuticas e vários problemas do setor. Atualmente trabalha como consultor independente. O blog Academia de Pacientes detém direitos exclusivos de reprodução dos posts de Neil Grubert em lingua portuguesa.

